Tác giả: Filippo Randelli, Patrizia Sartori, Cristiano Carlomagno, Marzia Bedoni Alessandra Menon, Elena Vezzoli, Michele Sommariva và Nicoletta Gagliano
Tổng quan:
Truyền tải cơ học là khả năng tế bào biến đối kích thích cơ học thành tín hiệu sinh học, cuối cùng là ảnh hưởng đến biểu hiện gen, hình thái tế bào và số phận tế bào. Tế bào Tenocyte chịu trách nhiệm về sự thích nghi cơ học của gân, giúp biến đổi các kích thích cơ học có trong quá trình truyền tải cơ học. Vì vậy tế bào tenocyte có ảnh hưởng đến cân bằng nội mô khoang ngoại bào. Trước đó chúng tôi đã chứng minh rằng: MD – Tissue, một chế phẩm y tế dạng tiêm với thành phần chính là collagen có nguồn gốc từ mô lợn sữa, có khả năng ảnh hưởng tới đặc tính của tế bào tenocyte. Vì thế, mục đích của nghiên cứu này là phân tích xem tác động của MD -Tissue có dựa trên cơ chế truyền tải cơ học hay không.
Vì mục đích này, MD – Tissue được phủ lên bề mặt đĩa petri, còn Cytochlasin B được sử dụng để loại bỏ các tế bào Tenocyte tham gia vào sự kích thích cơ học thông qua bộ xương tế bào actin. Hình thái tế bào, sự di chuyển tế bào, con đường luân chuyển collagen và sự biểu hiện của các cảm biến cơ học được phân thích thông qua phương pháp phân tử và hình thái học. Những phát hiện của chúng tôi xác nhận rằng: MD – Tissue tác động lên con đường luân chuyển collagen, hỗ trợ sự di chuyển tế bào và cho thấy những tác động do MD – Tissue gây ra đại diện cho một đầu vào cơ học liên quan đến bộ máy truyền tải cơ học. Nhìn chung, MD – Tissue, hoạt động như giàn giáo cơ học, là một thiết bị y tế trong liệu pháp điều trị mới, phương pháp tái tạo và phục hồi các gân bị tổn thương trong các bệnh lý về gân.
1. Giới thiệu
Bệnh lý gân (Tendinopathy) là tình trạng đau mạn tính ảnh hưởng đến gân, đặc trưng bởi sự biến đổi mô học như tăng tế bào, tân tạo mạch mới , mất các tổ chức sợi collagen, tăng hàm lượng proteoglycan và glycosaminoglycan cũng như tăng sinh thành phần khác không phải collagen của khoang ngoại bào. Các liệu pháp điều trị bệnh gân bao gồm: nghỉ ngơi, chườm đá, NSAIDs, vật lý trị liệu, tiêm corticoid tại chỗ, liệu pháp sinh học và tái tạo sử dụng huyết tương giàu tiểu cầu (PRP) hay Acid hyaluronic.
Tuy nhiên, điều trị bệnh lý về gân vẫn còn là một nhu cầu lâm sàng chưa được đáp ứng. Vì các phương pháp điều trị hiện có không cho thấy hiệu quả mạnh mẽ, cũng như không có lợi ích kéo dài nào được báo cáo. Phương pháp điều trị mới cũng cần thiết đối với thuốc thú y, đặc biệt là điều trị tổn thương gân và các rối loạn cơ xương khớp ở ngựa.
MD – Tisse (MD) là một thiết bị y tế dùng đường tiêm với thành phần chính là collagen từ mô lợn sữa. Collagen từ mô lợn sữa có tính tương đồng sinh học cao với collagen người, ít nguy cơ gặp tác dụng bất lợi khi sử dụng phối hợp với nhiều chế phẩm y học khác nhau và cũng được sử dụng để điều chế chất tạo nền giống da dựa trên collagen.
Thật vậy, các nghiên cứu lâm sàng báo cáo rằng: MD-KNEE – một thiết bị y tế dựa trên Collagen có thành phần tương tự MD, có khả năng dung nạp tốt và không có trường hợp gặp bất lợi toàn thân hay biến chứng nhiễm trùng nào được ghi nhận sau khi sử dụng cho bệnh nhân. Vì vậy, MD có thể có tiềm năng lớn trong điều trị bệnh lý về gân. Đặc biệt, có thể dùng đơn độc hoặc kết hợp với liệu pháp khác, chi phí thấp hơn so với HA nên có thể được ưu tiên sử dụng nhiều hơn. Ngoài ra, MD còn có một số lợi thế hơn so với các yếu tố sinh học.
Tế bào Tenocyte là các nguyên bào sợi đặc biệt trong gân liên kết với phần mềm, chịu trách nhiệm sửa chữa khoang ngoại bào của gân. Bằng cách ảnh hưởng tới con đường luân chuyển của collagen type I (COL-I), thành phần chính trong khoang ngoại bào của gân.
Gân đan xen giữa cơ và xương, giúp truyền tải lực gây ra do co cơ đến xương. Lực cơ học trên gân ảnh hưởng tới hoạt động trao đổi chất, biểu hiện gen và protein trong suốt quá trình sửa chữa khoang ngoại bào của tế bào tendocyte, đóng vai trò chính trong hoạt động truyền tại năng lượng.
Truyền tải cơ học là khả năng tế bào biến đối kích thích cơ học thành tín hiệu sinh học, cuối cùng là ảnh hưởng đến biểu hiện gen, hình thái tế bào và số phận tế bào. Truyền tải cơ học cho phép tế bào đáp ứng với ngoại lực và giải thích được các đặc tính cơ học của ngoại bào. Bằng cách này, tế bào tenocytes có thể đáp ứng kịp thời các biến đổi động học liên tục diễn ra ở ECM bằng cách sửa chữa nó. Gần đây chúng tôi phân tích tác dụng vitro của MD trên tế vào tenocyte của người.
Chúng tôi đã tập trung vào con đường luân chuyển collagen để mô tả lại cơ chế phân tử bị kích hoạt bởi MD, và để hiểu cách nó tác động lên đặc tính cơ học của tế bào Tendocyte để hỗ trợ cân bằng nội mô và sửa chữa gân. Trên thực tế, trong nghiên cứu đó, chúng tôi báo cáo rằng MD có thể kích thích quá trình tổng hợp, bài tiết và trưởng thành của COL – I, đồng thời gây ra sự tăng sinh và di cư của tế nào Tenocyte. Vì tế bào tenocyte hoạt động như các cảm biến cơ học và MD được chứng minh có khả năng tác động lên con đường luân chuyển collagen và sự di chuyển của tế bào nên mục đích của nghiên cứu này là phân tích xem liệu các tác động gây ra bởi MD có dựa trên cơ chế truyền tải cơ học không?
2. Đối tượng và phương pháp nghiên cứu
2.1 Mẫu
Mảnh vỡ từ gân cơ mông bé (Gluteus Minimus tendon) của người thu được từ 4 bệnh nhân (độ tuổi trung bình là 62.25 ± 4.57, 2 nam và 2 nữ) được thay toàn bộ khớp háng bằng phương pháp trước đó nhưng không có bệnh lý về gân cơ mông (hình 1).
Tiêu chí loại trừ:
- Những bệnh nhân được chẩn đoán viêm gân mấu chuyển lớn (great trochanter tendinopathy),
- Bệnh nhân bị ảnh hưởng bởi rối loạn collagen di truyền,
- Bệnh nhân viêm khớp cột sống liên quan đến hông bị ảnh hưởng
- Bệnh nhân viêm khớp vảy nến
- Bệnh nhân nghiện rượu và ma túy, phụ nữ có thai, cho con bú
- Bệnh nhân đái tháo đường hoặc người dùng Fluoroquinolones trong 30 ngày trước khi phẫu thuật.
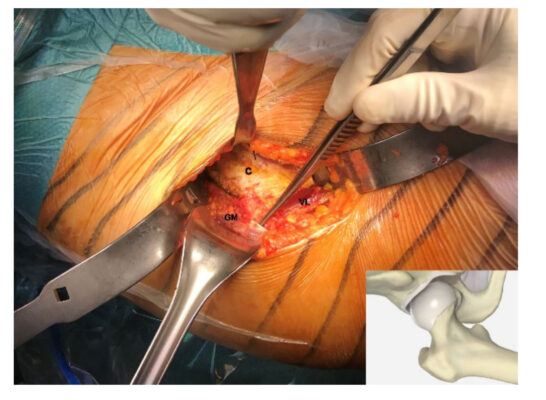
Hình ảnh 1: Thu lấy 1 mảnh vỡ nhỏ từ gân cơ mông bé (GM), được chỉ định kẹp phẫu thuật, trong suốt quá trình thay khớp toàn bộ bằng phương pháp trước đó. Mảnh nhỏ được thu thập ở chất giữa gân, phần màu trắng có cấu trúc mô liên kết dày đặc. Nang hông ( C) đã được phân lập và cơ Vastus Lateralis (VS) có thể nhìn thấy được ở dưới vùng phẫu thuật. (cơ Vastus Lateralis: phần cơ bắp nằm ở má ngoài cạnh bên của đùi).
Đối với mỗi gân thu được, chất giữa, phần có cấu trúc đặc biệt của mô liên kết dày đặc, đã được phân lập và phân tích.
Tất cả các đối tượng đã đồng ý tham gia nghiên cứu. Nghiên cứu được thực hiện theo tuyên ngôn Helsinki và quy trình đã được phê duyệt bởi Ủy ban đạo đức địa phương (San Raffaele Hospital Ethical Committee, Milan, Italy) của tổ chức điều phối (IRCCS Policlinico San Donato, Milan, Italy) (63/INT/2017).
2.2 Tế bào nuôi cấy
Các mảnh gân được thu lại và làm sạch ngay lập tức bằng PBS vô trùng. Chúng được đặt trong bình T25 và được ủ trong môi trường DMEM, bổ sung thêm 10% huyết thanh bò thái bất hoạt nhiệt (FBS) (Gibco, Life Technologies, Monza, Ý) và kháng sinh (100 U / mL penicillin, 0,1 mg / mL streptomycin) (Euroclone), ở 37 ◦C trong môi trường ẩm có chứa 5% CO2. Khi tế bào tenocyte phát triển trên mẫu cấy, chúng tôi thu hoạch và nuôi cấy trong bình T75. Tế bào tenocyte người được trong mỗi mẫu được nuôi cấy nhân đôi. Để đánh giá hình thái, chức năng và phân tử, tế bào tenocyte hợp lưu được nuôi cấy trong các đĩa 6 giếng ở đoạn thứ năm, thêm acid ascorbic (200 µM) vào DMEM để bảo toàn tổng hợp collagen và thu hoạch sau 48 giờ. Sơ đồ tóm tắt thiết kế thí nghiệm của nghiên cứu được thể hiện trong Hình 2.
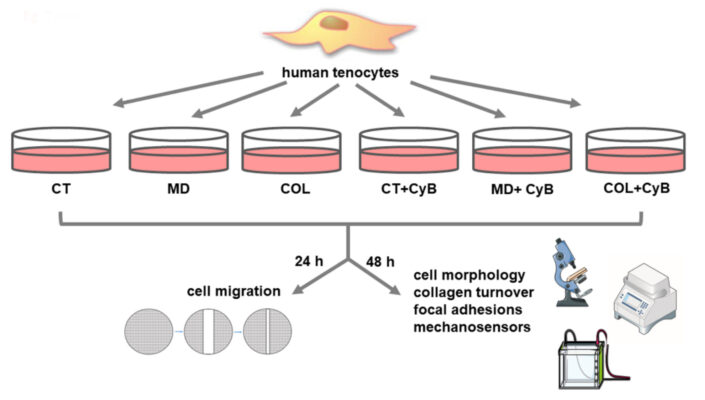
Hình 2.Sơ đồ tóm tắt thiết kế thí nghiệm của nghiên cứu
2.3. Lớp phủ MD-Tissue or Collagen
MD – Tissue (MD) và collagen (COL) được cung cấp bởi Guna (lilan, Italy).
COL có nguồn gốc từ mô lợn sữa, thành phần chính của MD, có chứa acid ascorbic, magnesium gluconate, vitamin B1, B2, B6, NaCl, Nước.
MD hoặc COL (50 µg/mL) được sử dụng để tạo một lớp phủ mỏng trên đĩa 6 giếng được mô tả ở phần trước. Sau khi ủ ít nhất 3 – 4 h ở nhiệt độ phòng để có được sự kết dính collagen vào nhựa, chất lỏng dư thừa sẽ được loại bỏ khỏi bề mặt lớp phủ và đĩa đa giếng được làm khô dưới tủ hút lớp màng.
Nhựa tráng được sử dụng ngay lập tức hoặc được bảo quản ở 4 ◦C. Các tế bào được nuôi cấy trên MD-Tissue hoặc COL được so sánh với các tế bào được nuôi cấy trên nhựa không tráng phủ, được sử dụng làm đối chứng không được xử lý (CT).
2.4. Bổ sung Cytochalasin
Để hiểu xem liệu MD có tác động lên tế bào tenocyte thông qua kích thích cơ học hay không, tế bào được thêm 10 µM cytochalasin B (CyB) để ức chế quá trình trùng hợp sợi actin. Liều CyB dùng để ức chế tenocyte được chọn theo y văn. Hơn nữa, các liều lượng khác nhau đã được thử nghiệm để đánh giá các thay đổi vi sợi có thể dẫn đến tổn thương tế bào.
2.5 Phương pháp
- Quét kính hiển vi điện tử
- Quang phổ Raman
- Phân tích miễn dịch huỳnh quang
- Real-Time PCR
- Slot Blot
- Western Blot
- SDS-Zymography
- Thử nghiệm chữa lành vết thương
- Phân tích thống kê
3.Kết quả
3.1 Phân tích và đặc tính của lớp phủ
Sự có mặt và đặc tính của lớp phủ thu được ở MD hoặc COL được phân tích bằng phương pháp quét kính hiển vi điện tử (SEM). Chúng tôi không phát hiện ra sợi collagen trong bề mặt đĩa petri chứa MD hoặc COL (Hình ảnh 3), so sánh với CT. Để đối chứng, chúng tôi so sánh đĩa petri được phủ MD và COL với đĩa petri được phủ Collagen type 1 có sẵn trên thị trường (CELLCOAT Type I Collagen—Greiner bio-one cod.628950), trong đó sự có mặt của lớp phủ cũng không được phát hiện bằng SEM.
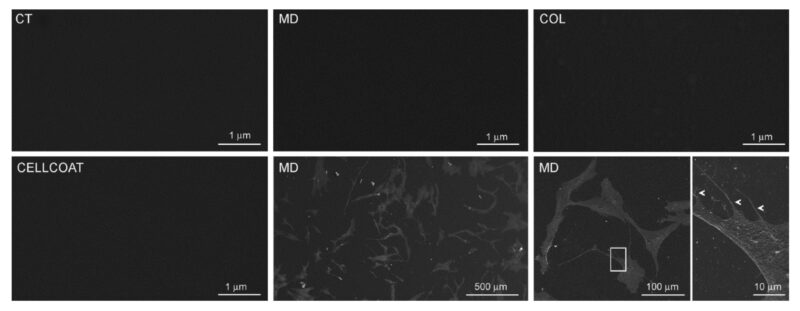
Hình 3: Hình ảnh SEM của đĩa Petri không được phủ gì (CT) hoặc được phủ MD-Tisue(MD) hoặc được phủ dung dịch collagen (COL). Hình ảnh SEM của đĩa petri thương mại được phủ Collagen type 1(CELLCOAT Type I Collagen—Greiner bio-one cod.628950) được hiển thị.
Hình ảnh SEM của tế bào tenocytes người được nuôi cấy trên đĩa petri phủ MD-Tissue với độ phóng đại thấp (bên trái) và độ phóng đại cao ( bên phải); ở mặt trong của độ phóng đại cao hơn, quá trình dẹt mỏng kéo dài từ thân tế bào (đầu mũi tên) có thể nhìn thấy được.
Thanh tỷ lệ được chỉ ở dưới bên phải của mỗi bức ảnh.
Để hiểu liệu lớp phủ có ảnh hưởng đến sự liên kết tế bào không, tế bào được nuôi dưỡng trên tấm kính có đường kính 12mm được phủ MD: Phân tích SEM xác nhận rằng sợi collagen không được phát hiện và lớp phủ không tạo ra các liên kết tế bào. Thật vậy, tế bào được sắp xếp mà không theo bất kì hướng nào (hình 3).
Vì phân tích hình thái không có khả năng xác nhận sự có mặt của lớp phủ, chúng phân tích các mẫu vật bằng quang phổ Raman. Như đã được mô ra trong phần Đối tượng và phương pháp, MD và COL được lắng đọng trên một lớp calci fluoride và làm khô qua đêm. Phân tích kính hiển vi cho thấy 2 vùng riêng biệt trong MD, đặc trưng bởi sự hình thành tinh thể và sự phân tán dạng sợi (hình 4a-c). Phân tích Raman tập trung vào 2 vùng này.

Hình 4: a. Hình ảnh trên kính hiển vi ánh sáng của MD trên calci Fluoride (độ phóng đại gốc 50x). Ở mặt trong, phần tinh thể (b) và phần dạng sợi ( c) ở độ phóng đại cao hơn (100x) được hiển thị. Tín hiệu Ramma thu được từ phần tinh thể (d) và phần dạng sợi ( e). Các dải màu xám hiển thị độ lệch chuẩn liên quan. (f) So sánh giữa phần collagen tinh khiết và phần sợi MD, với các đỉnh quan tâm được đánh dấu bằng các mũi tên màu đen. (g) Phổ trừ của phần sợi MD và collagen nguyên chất thu được sự lan truyền lỗi.
Phần tinh thể hiển thị đỉnh nhọn đặc trưng của cấu trúc tinh thể, với đỉnh thuộc về tín hiệu đặc trưng của riboflavin (750, 1345, 1410 cm−1) và acid ascorbic (605 và 632 cm−1) (hình ảnh 4d), cả sự hiện thị của chế phẩm MD. Phần sợi chủ yếu gồm collagen vì sự hiển thị các đỉnh đặc trưng ở 536, 858, 919, 1065, 1343, 1454 và 1674 cm−1 (Hình ảnh 4e).
So sánh giữa COL và phần sợi MD (Hình ảnh 4f) xác nhận đỉnh phổ biến ở 500, 580, 829, 1248, 1430 và 1650 cm−1 với sự khác biệt một phần trong hình dạng phổ toàn cục. Một giải thích tiềm ẩn có thể được tìm thấy là: MD trong dung dịch sản phẩm chứa muối hòa tan có thể thể thay đổi và điều chỉnh cấu trúc, tương tác với môi trường và cấu trúc của protein.
Bảng 1: Phân bố các đỉnh tiềm năng, dựa theo Carcamo và cộng sự
| Raman Shift (cm−1) | Attribution |
| 475 | Biến dạng xương |
| 508 | Biến dạng xương |
| 800 | Skeletal C-C vibrations |
| 920 | C-COO− vibrations |
| 992 | Phenylalanine |
| 1015 | Vibration of Proline C-N |
| 1055 | Distortion of Proline N-C-H |
| 1235 | Amide III |
Bảng 1. Cont.
| Raman Shift (cm−1) | Attribution |
| 1403 | Deformation of CH3 |
| 1443 | Deformation of CH3 |
| 1544 | Deformation of NH3+ |
| 1665 | Amide I |
3.2 Hình thái học tế bào
Trước khi phân tích tác dụng của MD và COL trên tế bào tenocyte, chúng tôi quan sát bộ xương tế bào actin trong các tế bào được bổ sung CyB với liều khác nhau. Tế bào Tenocyte có các vi sợi dài, hầu hết được sắp thành mảng thẳng đứng song song với trục dọc dài của tế bào.
Ở nồng độ 10 µM, CyB có thể ngăn chặn sự mất ổn định động học của bộ xương tế bào actin, nhằm loại bỏ các tế bào tenocyte khỏi các kích thích cơ học qua trung gian sợi actin. Ở nồng độ này, các vi sợi chỉ bảo toàn tính toàn vẹn và sự phân bố của chúng, mà không có bất kì sự biến đổi về hình thái học nào và không gây hại đáng kể đến bộ máy cảm ứng cơ học. Nồng độ cao hơn gây ra sự mất các sợi actin, dần trở nên rõ ràng hơn khi tăng liều (hình 5a).
Phân tích hình ảnh kính hiển vi tương phản pha cho thấy hình thái tế bào không bị ảnh hưởng khi được nuôi trong MD và COL, so sánh với CT. Tuy nhiên, khi được thêm CyB, tế bào tenocyte nuôi cấy trong MD và COL không làm thay đổi hình thái tế bào, trong khi tế bào CT trở nên ít dẹt và trong hơn, gợi ý rằng chúng ít gắn vào chất nền hơn.
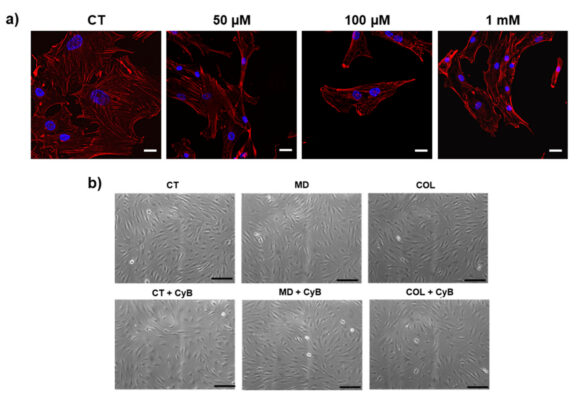
Hình 5: (a) hình ảnh hiển vi hiển thị các sợi actin được phát hiện bằng rhodamine-phalloidin bởi THUNDER trong tế bào kiểm soát (CT) và sau khi sử dụng CyB ở liều chỉ định. Sau 50 µM CyB, sợi actin trở nên ngắn và rõ ràng hơn, cho thấy rằng bộ xương tế bào không được bảo tồn sau khi thêm CyB. (b) Hình ảnh hiển vi tương phản của pha đại diện cho thấy hình thái tế bào phát triển trong MD và COL, so sánh với CT. Sau khi thêm CyB, tế bảo CT trở nên ít phẳng và tròn hơn (hình 4b). Thanh tỷ lệ 200 µm và 20 µm.
3.3 Biểu hiện Gen và Protein liên quan đến luân chuyển Collagen
Nồng độ protein COL – 1 được tiết ra bởi tế bào Tenocyte trong chất nền tế bào được phân tích bởi phương pháp Slot Blot. Phân tích thống kê sử dụng T-test cho thấy sự bài tiết COL-1 tăng đáng kể trong tế bào cấy trên MD (p=0.033) và có xu hướng gia tăng ở tế bào nuôi dưỡng trên COL (P=0.008), so sánh với CT. Sử dụng CyB không ảnh hưởng đến bài tiết COL-1 của tế bào tenocytes (hình 6a). Giá trị p của ANOVA có ý nghĩa thống kê (p = 0.0056) và post – test cho thấy sự tăng đáng kể của COL-1 trong COL so với CT (p=0.041, ở COL so với CT+CyB (p=0.011) và COL+ CyB vs. CT+CyB (p = 0.022).
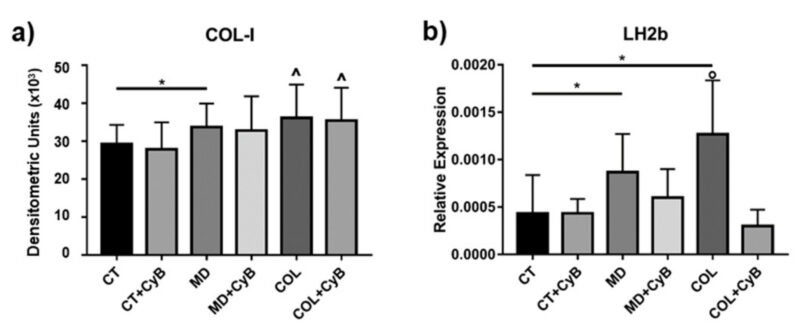
Hình ảnh 6: Biểu đồ cột cho thấy nồng độ COL-1 thu được bằng cách sử dụng Slot blot sau khi quét mật độ của các dải phản ứng miễn dịch trong điều kiện thử nghiệm được xem xét. Dữ liệu được biểu thị dưới dạng ± SD. (b) nồng độ mARN đối với Long lysyl hydroxylase 2 (LH2b) ở CT và tế bào Tenocyte được nuôi dưỡng trong MD và COL có hoặc không có CyB được đánh giá bằng real-time PCR. Dữ liệu được chuẩn hóa trên sự biểu hiện gen GAPDH và được biểu thị dưới dạng ± SD đối với ít nhất 2 thí nghiệm độc lập. * p < 0.05 using t-test. ˆ p < 0.05 vs. CT, CT+CyB, COL+CyB vs. CT+CyB; ◦ p < 0.05 vs. CT and COL+CyB using ANOVA.
Sự trưởng thành của collagen được phân tích bằng cách đánh giá nồng độ mARN đối với Long lysyl hydroxylase 2 (LH2b), liên quan đến liên kết chéo của collagen mới được tổng hợp, bằng real-time PCR. Nồng độ LH2b mARN cao hơn đáng kể ở tế bào Tenocyte được nuôi dưỡng trong MD và COL (tương ứng là p=0.039 và 0.020), so sánh với CT. Việc sử dụng CyB làm giảm sự biểu hiện của gen LH2b trong tế bào nuôi dưỡng MD và COL, (p = 0.053 for COL vs. COL+CyB), nhưng không có ở CT (hình 6b). Phát hiện này gợi ý rằng, điều hòa lên của LH2b gây ra bởi lớp phủ bị tấn công bởi một kích thích cơ học thông qua trung gian bộ xương tế bào actin. Giá trị p của ANOVA là 0.0095 và post-test xác nhận sự cảm ứng LH2b khi COL so sánh với CT (p=0.025) và cho thấy sự giảm đáng kể trong COL +CyB vs. COL (p=0.025).
Sự suy thoái của collagen kẽ (Interstitial collagen) được thúc đẩy bởi MMP-1. Phân tích Slot blot nồng độ MMP-1 trong dịch nuôi cấy tế bào cho thấy rằng collagenase này vẫn không ảnh hưởng đến tế bào tenocytes được nuôi cấy trong MD và COL, so sánh với CT, cũng như sau khi sử dụng CyB (Hình 7a, c). Một mô hình biểu hiện tương tự đã được quan sát đối với hoạt động phân giải của MMP-2, đánh giá thông qua SDS – zymographu (hình 7b,d). Một mô hình tương tự khác cũng được qua sát đối với TIMP-1, chất ức chế chính đối với TIMP-1, phân tích mức độ biểu hiện gen bằng real-time PCR. Mức TIMP-1 mARN cho thấy sự khác biệt lớn giữa các cá thế và và biến đổi tương tự bởi CyB trong tất cả các nhóm thử nghiệm. (hình 7e)
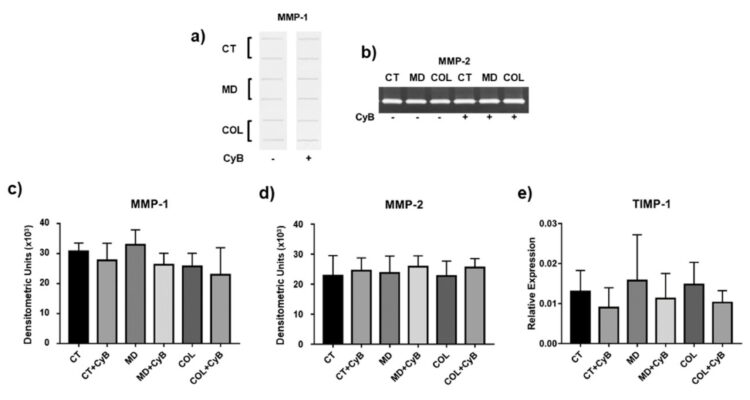
Biểu đồ 7: Phân tích slot blot đại diện cho mức độ MMP-1 (a) và SDS zymography cho thấy hoạt động của MMP-2 (b) Phân tích thử nghiệm trong tế bào nổi không có huyết thanh của tế bào tenocyte được nuôi cấy trong môi trường thử nghiệm được xem xé. Biểu đồ cột cho thấy mức độ protein MMP-1 (c) và hoạt động MMP-2 (d) sau khi phân tích mật độ của phản ứng miễn dịch và dải lytic tương tự.
Dữ liệu được biểu thị dưới dạng ± SD cho ít nhất 2 thí nghiệm độc lập. (c,e) biểu đồ cột cho thấy sự biểu hiện gen TIMP-1 sau khi tiêu chuẩn hóa mức độ GAPDH mARN. Dữ liệu được biểu thị dưới dạng ± SD cho ít nhất 2 thí nghiệm độc lập.
3.4 Sự sắp xếp bộ xương tế bào và biểu hiện Vinculin trong kết dính khu trú (Focal Adhesion)
Để hiểu liệu MD và COL có thể đại diện cho một kích thích cơ học có thể ảnh hưởng đến khả năng hình thành kết dính khu trú của tế bào tenocytes hay không, chúng tôi phân tích sự biểu hiện của VNC, protein quan trọng liên quan đến sự hình thành mảng bám bằng phương pháp phân tử và hình thái học. Phân tích western blot chỉ ra rằng mức độ protein VNC điều hòa lên đáng kể trong tế bào được nuôi trong MD (MD vs. CT, p = 0.033) và có xu hướng tăng ở tế bào được nuôi trong COL. Trong nhóm thí nghiệm này, VNC tăng đáng kể khi có CyB (COL vs. COL+CyB, p = 0.040) (Hình ảnh 8a,b).
Những tác động khi có mặt giàn giáo và sử dụng CyB rõ ràng hơn khi sử dụng phương pháp phân tích hình thái học thông qua miễn dịch huỳnh quang. Do đó, phản ứng miễn dịch VNC, khu trú tại các cực của sợi actin tương ứng với vùng kết dính khu trú (focal adhesion) hình thành trên chất nền, được phát hiện là mạnh hơn và rộng hơn ở tế bào tenocyte được nuôi cấy trong MD và COL, so sánh với CT (Hình 8c). Sau khi dùng CyB, tín hiệu miễn dịch huỳnh quang VNC và các vùng tương ứng với sự hiện diện của kết dính khu trú (focal adhesion) dường như ít rõ ràng và nhỏ hơn ở tế bào chỉ nuôi dưỡng trong MD và COL, nhưng không có ở CT, trở nên tương tự CT (Hình 8c, các mũi tên))
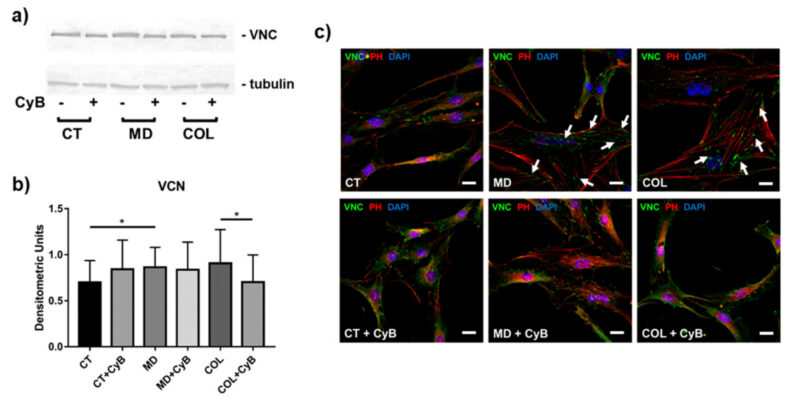
Hình 8: (a) Phân tích Western blot tiêu biểu để định lượng VNC trong dịch tế bào thu được từ tế bào được nuôi dưỡng trong MD và COL, so sánh với CT, có hoặc không có điều trị CyB. Biểu hiện VNC được tiêu chuẩn hóa trên tubulin. (b) Biểu đồ cột cho thấy sự biểu hiện VNC sau khi phân tích mật độ của dải phản ứng miễn dịch. Dữ liệu được biểu thị dưới dạng ± SD cho ít nhất 2 thí nghiệm độc lập. (c) phân tích miễn dịch huỳnh quang cho VNC (xanh) trong tế bào tenoxyte được nuôi dưỡng trong MD và COL, so sánh với CT, trước và sau khi điều trị CyB. Sợi actin đã được nhuộm bằng cách ghi nhãn rhodamine-phalloidin. Hạt nhân được nhuộm xanh bằng DAPI. Độ phóng đại gốc: 60x. Mũi tên màu trắng chỉ chất kết dính liên kết chứa VNC lớn hơn và rõ ràng hơn khi đánh giá trên mẫu MD và COL, so sánh với mẫu tương tự được xử lý bằng CyB. CyB làm thay đổi kích thước của chất khu trú chứa VCN tương tự CT. VNC: vinculin; PH: phalloidin. Thanh tỷ lệ: 20 µm. * p < 0.05 sử dụng t-test
3.5 Thử nghiệm chữa lành vết thương
Sự di chuyển tế bào, đóng vai trò quan trọng trong quá trình chữa lành gân, được đánh giá bởi 1 thử nghiệm chữa lành vết thương ở tế bào tenocyte trong môi trường CT, MD và COL có hoặc không có CyB. Việc định lượng kích thước vết xước cho thấy sự di chuyển tế bào tăng đáng kể đối với tế bào tenocytes nuôi trong MD và COL, so sánh với CT (tương ứng p = 0.023 and p = 0.032). Ngược lại, sự di chuyển tế bào không bị ảnh hưởng khi cho thêm CyB vào CT, nhưng giảm mạnh ở MD ( MD vs. MD+CyB, p = 0.040) và mặc dù không có ý nghĩa thống kê, ở tế bào tenocyte trong COL (COL vs. COL+CyB, p = 0.07) (hình 9a,b). Giá trị ANOVA là 0.001 và post – test xác nhận sự gia tăng di chuyển giảm ở COL so với CT (p=0.015) và cho thấy tăng đáng kể sự di chuyển của tế bào nuôi cấy trong MD và COL so sánh với CT+ CyB (p=0.009 và p=0.001)
3.6 Sự biểu hiện của FAK, PAX và YAP/TAZ như một cảm ứng cơ học
Để hiểu xem giàn giáo chứa MD và COL có ảnh hưởng lên sinh học tế bào tenocyte bằng cách kích thích cơ học hay không, thì sự biểu hiện của protein đóng vai trò quan trọng giống như cảm ứng sinh học đã được phân tích.
Fak và PAK là các protein trong mảng bám dính, hoạt động như một cảm ứng cơ học. Mức độ mARN có xu hướng điều hòa lên ở tế bào tenocytes được nuôi dưỡng trong MD và COL, so sánh với CT tuy nhiên không có ý nghĩa thống kê (p=0.09). Thêm CyB không ảnh hưởng đến FAK ở CT nhưng có tác động đến biểu hiện gen ở tế bào nuôi trong MD (p=0.09) và COL, phát hiện thấy sự giảm của nó (hình 10a). ANOVA cho thấy rằng mức độ m ARN FAK được điều hòa lên ở MD so với CT (=0.017) và với CT + CyB (p=0.020) và chúng bị giảm ở MD so với MD + CyB (p=0.013) VÀ col + cYb (0.018). Một mẫu tương tự được đánh giá đối với PAX: sự biểu hiện của nó cao hơn MD (p=0.075) và COL, so sánh với CT và bị giảm bởi CyB chỉ thấy ở tế bào nuôi trong gian giáo (p = 0.07 for MD vs. MD+CyB and p < 0.05 for COL vs. COL+CyB), trong khi vẫn không thay đổi ở CT (hình 10b). Phân tích biểu hiện gen PAX bằng ANOVA cho thấy rằng sự biểu hiệu gen PAX tăng đáng kể ở MD so với CT và với CT + CyB (tương ứng với (p = 0.0059 and p = 0.052), trong khi nó giảm ở MD + CyB (p=0.003) và COL + CyB (p=0.007) so với MD.
YAP (Yes-associated protein) và chất đồng hoạt hóa phiên mã với PDZ-binding motif (TAZ) là các cảm ứng sinh học mà hoạt động của chúng được điều hòa bằng quá trình phosphoryl hóa, dẫn đến bất hoạt protein và chuyển vị tế bào chất. YAP/ TAZ lần đầu tiên được phân tích bằng phương pháp Western blot sử dụng kháng thể để nhận diện cả protein chưa phosphoryl hóa (dạng hoạt động) và protein đã phosphoryl hóa (dạng bất hoạt). YAP và p- YAP đều dẫn đến biểu hiện tương tự nhau trong dịch ly giải tế bào tenocyte thu được ở mẫu CT, MD và COL. Tuy nhiên, một sự điều hòa xuống đáng kể được quan sát thấy sau khi thêm CyB ở tế bào được nuôi cấy trong MD (p=0.044) (hình 10c). p-YAP dẫn đến kết quả tương tự nhau trong tất cả các điều kiện thử nghiệm (hình 10d), cũng như tỷ lệ YAP/p-YAP ở (hình 10e). Mộ mô hình tương tự được quan sát thấy đối với TAZ và p-TAZ (dữ liệu không được hiển thị).
Để hiểu liệu MD hay COL có thể gây ra một kích thích cơ học trong tế bào tenocytes hay không, sự hoạt hóa YAP/TAZ gây ra bởi giàn giáo được nghiên cứu bằng cách phân tích vị trí thông qua miễn dịch huỳnh quang. YAP/TAZ được biểu hiện ở cả ở trong nhân và tế bào chất. Chúng tôi quan sát thấy một phản ứng miễn dịch mạnh hơn ở tế bào tenocyte được nuôi dưỡng trong MD và COL, so sánh với CT. Trong CT, CyB không làm thay đổi đáng kể sự biểu hiện của mẫu. Trong khi ở tế bào tenocyte nuôi cấy trong MD và COL, CyB làm tăng mạnh số lượng hạt nhân có ít cường độ YAP/TAZ. Điều này gợi ý rằng: sự thiếu hụt kích thích cơ học sau khi thêm CyB đã làm bất hoạt YAP/TAZ và giảm chuyển vị của chúng từ nhân sang tế bào chất.

Hình 9. (a) Hình ảnh hiển vi tương phản của pha đại diện cho thấy kết quả của thử nghiệm chữa lành vết thương trong tế bào tenocyte đối chứng (CT) và tế bào tenocyte nuôi cấy trong MD và COL ở 0 và 24h sau vết xước, có hoặc không sử dụng CyB. Độ phóng đại ban đầu: 10x. (b) Biểu đồ thanh thể hiện diện tích vết thương đã đóng sau 24h, biểu thị bằng a% diện tích ở thời điểm 0h, trong tế bào tenocytes nuôi cấy trong các điều kiện thử nghiệm khác nhau. Dữ liệu biểu thị dưới dạng ± SD ở ít nhất 2 thí nghiệm độc lập. * p < 0.05 đối với t-test; ˆ p < 0.05 vs. CT; ˆˆ p < 0.01 vs. MD và COL sử dụng ANOVA
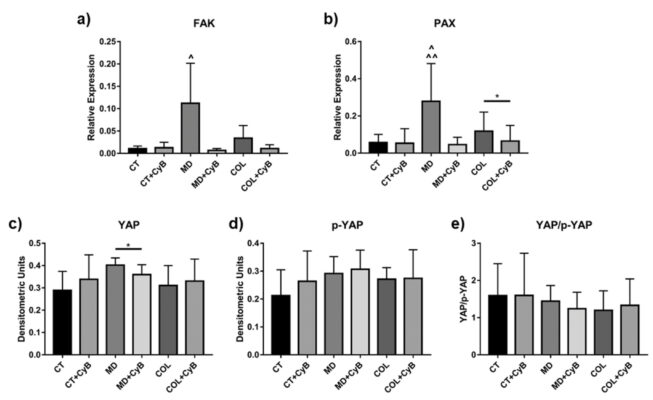
Hình ảnh 10. Biểu đồ thanh thể hiện mức độ mARN của FAK (a) và của PAX (b) sau khi tiêu chuẩn hóa biểu hiện gen GAPDH. Dữ liệu được biểu thị dưới dạng ± SD, với ít nhất 2 thí nghiệm độc lập. Đối với biểu hiện YAP, dạng hoạt hóa của YAP (c), Dạng phosphoryl hóa bất hoạt (d) và dạng tỷ lệ YAP/p-YAP được đánh giá bằng Western blot và biểu diễn dưới dạng biểu đồ hiển thị trung bình ± SD với ít nhất 2 thử nghiệm độc lập cho các nhóm thí nghiệm được xem xét.
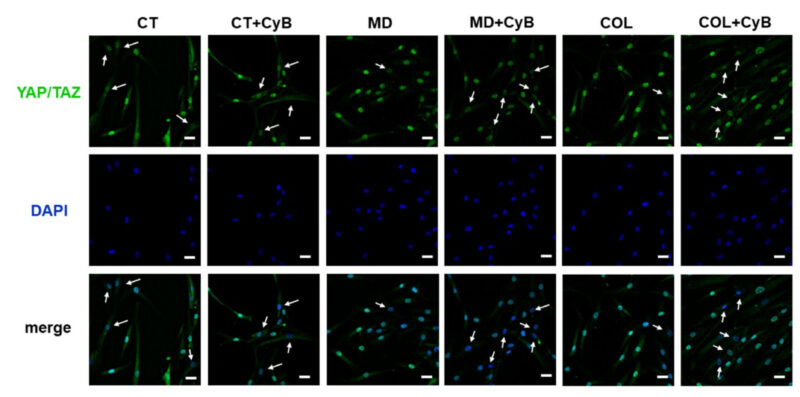
Hình ảnh 11. Phân tích miễn dịch huỳnh quang cho YAP/TAZ (màu xanh lá cây) ở tế bào tenocyte được nuôi cấy trong MD và COL, so sánh với CT, trước và sau khi bổ sung CyB. Hình ảnh hiển vi hợp nhất cho thấy rằng: ở tế bào tenocyte nuôi cấy trong MD và COL, đáp ứng miễn dịch trong nhân rõ ràng hơn. Trong khi, sau khi xử lý CyB và trong CT, đáp ứng miễn dịch chủ yếu ở trong tế bào chất và nhân có màu xanh lam. Gợi ý rằng sự có mặt của MD và COL gây ra sự hoạt hóa YAP/TAZ, trong khi sự giảm sức căng cơ học gây ra kiểu hình giống với tế bào CT hơn. Độ phân giải gốc: 60x, tỷ lệ thanh 20 µm.
5. Kết luận
Xem xét một cách tổng thể, những phát hiện invitro này cho thấy MD và COL kích hoạt đáp ứng tương tự trong tế bào tenocyte và ảnh hưởng của chúng đối với hoạt động của tế bào tenocyte thể hiện bằng một đầu vào cơ học liên quan đến truyền tải cơ học. Đặc biệt, chúng tôi đã chỉ ra rằng, MD – Tissue ảnh hưởng tới một vài hoạt động của tế bào tenocyte liên quan với cân bằng nội mô khoang ngoại bào và cải thiện sự hình thành kết dính khu trú cũng như khả năng di chuyển. Nhìn chung, chúng tôi xác nhận rằng MD – Tissue, hoạt động giống như một giàn giáo cơ học, là một thiết bị y tế hiệu quả trong liệu pháp điều trị mới, phương pháp sửa chữa và tái tạo để hỗ trợ điều trị tổn thương gân trong các bệnh lý về gân.